Coraz więcej trafia do mnie kobiet z wynikami badań MTHFR, po nieudanych próbach zajścia w ciąże.
Problem przez większość lekarzy jest bagatelizowany, a często też zalecone przez nich suplementy, mogą czasem zaszkodzić, a nie pomóc.
Niekorzystny wariant MTHFR dotyka prawię połowę naszej populacji.
Ostatecznie nieudane próby zajścia w ciąże, poronienia, złe samopoczucie, problemy kardiologiczne, zaburzenia rozwojowe u dzieci itp. prowadzą do diagnostyki polimorfizmów genetycznych w tym MTHFR.
Ale po kolei…
Organizm to system sprzężonych ze sobą informacji, to kaskada niewyobrażalnej ilości procesów, które muszą być skoordynowane co do ułamka sekundy, to działające na siebie cząsteczki chemiczne, które są wzajemnie zależne itp. Ilość i jakość produktów w końcowych reakcjach biochemicznych naszego organizmu musi być na tyle dobra, aby procesy zachodziły poprawnie, a produkty końcowe były bezpieczne dla organizmu.
To naprawdę w dużym skrócie.
Głównymi graczami w skomplikowanych systemach biochemicznych to enzymy, które katalizują (przyspieszają-wspierają) ważne reakcje. To takie lokomotywy, które ciągną wagoniki od stacji A do stacji B, a cała trasa którą pokonują nazywa się metylacją.
W sieci można znaleźć informację że „ …metylacją nazywany jest proces przekazywania grupy metylowej (-CH3) pomiędzy molekułami. Grupa metylowa jest przyłączana do enzymu, który pod jej wpływem ulega aktywacji i pełni odpowiednią funkcję. Jednym z częściej badanych defektów, powodujących zaburzenia metylacji, jest mutacja genu MTHFR zwanego reduktazą metylenotetrahydrafolianową, która według szacunków dotyczy więcej niż 40% populacji…”
Do czego służy metylacja?
Metylacja służy regulacji – bezpiecznej replikacji DNA, czyli powielania zestawu materiału genetycznego, warunkującego nasze funkcjonowanie. Cykl metylacji bierze też udział w pokonywaniu infekcji wirusowych, detoksykacji organizmu i usuwaniu metali ciężkich.
Metylacja może spowodować zahamowanie części źle działających genów, (dlatego ważne jest to w przypadku biomedycznego wspierania dzieci z ASD)
Metylacja może włączyć lub wyłączyć enzym, neuroprzekaźnik, włączyć naprawę tkanek, wyłączyć stan zapalny, włączyć i wyłączyć reakcję na stres…
Wspieranie metylacji jest ważne dla każdego, ale przede wszystkim dla osób z chorobami z autoagresji i dzieci z problemami rozwojowymi!
Jeżeli grup metylowych jest za mało, lub jest zaburzony ich cykl metylacyjny, przebieg procesów regulacyjnych, jest utrudniony, a więc jesteśmy narażeni na choroby i dolegliwości.
Jednym z ważnych procesów metylacji jest „zarządzanie” glutationem- bardzo silnym i jednym z głównych antyoksydantów wytwarzanym w organizmie.
Glutation bezpośrednio neutralizuje wolne rodniki, pomaga innym antyutleniaczom jak wit C, kw. liponowy. Dzięki swojej budowie chemicznej ma właściwości do usuwania toksyn i metali ciężkich z organizmu.
Za proces metylacji odpowiadają geny, wiek ale także środowisko zewnętrzne: dieta, niedobory składników pokarmowych, złe wchłanianie jelitowe, stres, skażenie środowiska, przetworzona, chemiczna żywność.
Jeżeli występuje u nas wariant niekorzystnych genów i potęgujemy je złymi codziennymi wyborami, włączamy- uruchamiamy potencjalnie drzemiące w nas choroby i dolegliwości.
MTHFR?
MTHFR- reduktaza metylenotetrahydrofolianu, jest enzymem przekształcającym folian w aktywną i ważną dla organizmu postać. Jeśli w genie kodującym ten enzym znajduje się mutacja, może dojść do ograniczeń ilościowych tego enzymu, a co za tym idzie nieprawidłowej ilości i jakości powstałych folianów.
Z folianami najczęściej po raz pierwszy spotykamy się w chwili gdy kobieta zachodzi w ciąże, wtedy to lekarz zaleca suplementacje kwasem foliowym. Zapomina się prawie zawsze o suplementacji przyszłych ojców. Przecież połowa genów pochodzi od mężczyzny! Ponieważ, w komórce jajowej i plemniku znajduje się materiał genetyczny, to u obojga przed ciążą (minimum 3 miesiące przed planowaniem) zaleca się doprowadzenie aktywnych folianów do optymalnego poziomu.
Niskie foliany mogą powodować u matki i dziecka:
- poronienia,
- wady cewy nerwowej,
- zaburzenia krzepliwości krwi, które mają wpływ na przepływ składników odżywczych, od kobiety do płodu przez łożysko,
- autyzm,
- zespół Downa,
- alergie dziecka,
Dbając o epigenetykę, czyli nasze codzienne wybory na planowaną ciąże i samą ciążę, możemy sterować zdrowiem naszego dziecka. To nieprawdopodobne, ale prawdziwe.
Co to jest kwas foliowy, foliany i dlaczego są one tak ważne?
Kwas foliowy to syntetyczna forma wit B9, dostępny w preparatach witaminowych, w naturze występuje w formie folianów. Wit B9 utożsamiana jest z szeregiem związków i w przyrodzie jest jej około 20 rodzajów.
Nazwa pochodzi od łacińskiego słowa folium, czyli liść, i dlatego największa jego ilość znajduje się w warzywach liściowych, głównie w szpinaku, jarmużu, boćwinie, sałacie, kapuście, brokule, szparagu, kalafiorze, brukselce oraz w mniejszych ilościach w pomidorze, grochu, fasoli, soczewicy, soi, buraku, orzechach, słoneczniku, drożdżach piwowarskich, wątrobie, żółtku jaja, pszenicy, pomarańczy, bananie i awokado.
Zbyt długie przechowywanie żywności może zniszczyć połowę zawartego w niej folianów, a podczas gotowania tracimy ich nawet w 70 proc. Organizm nie jest w stanie długo magazynować tej witaminy. Należy ją więc dostarczać codziennie, czyli jeść jak najwięcej surowych warzyw, zwłaszcza tych, w których występuje także witamina C (jej dodatek do pewnego stopnia chroni kwas foliowy przed rozpadem).
Ja polecam soki zielone z dodatkiem liści szpinaku, jarmużu, natki pietruszki, brokuła…mieszane z cytrusami, borówką amerykańską czy malinami. Oczywiście sprawdza się najlepiej przy robieniu takich soków wyciskarka wolnoobrotowa, która nie niszczy cennych witamin.
Foliany współdziałają synergistycznie z pozostałymi witaminami z gr B, więc gdy mowa o działaniu folianów, należy mieć także na uwadze wit. B12, B6, B2. Jeśli zaś chcemy wesprzeć metylację, należy zadbać o optymalny poziom magnezu i cynku.
W wielu krajach kwasem foliowym wzbogaca się pieczywo. Jest to folian syntetyczny i osoby z nieprawidłowym wariantem MTHFR nie są wstanie go konwertować. Może nawet dołożyć problemów, a nie pomóc.
Gdy mamy do czynienia z problemem tworzenia aktywnej formy folianów, powstaje szereg bardzo złożonych zależności, które mogą negatywnie odbić się na zdrowiu w różnych aspektach.
Często zdarza się, że na polimorfizm (wariant genetyczny) MTHFR, nakładają się jeszcze inne polimorfizmy, które niestety mogą komplikować jeszcze bardziej działanie MTHFR.
Może zdarzyć się, że wariant MTHFR jest tylko odziedziczony od jednego z rodziców i nie jest, aż tak silnie działający jak w przypadku wariantu od obojga rodziców.
Może zdarzyć się również, że mimo polimorfizmu w genie MTHFR organizm działa sprawnie w wyniku prawidłowej diety i zdrowego trybu życia.
Dlatego protokół interwencji dietetycznej i suplementacyjnej nie jest identyczny dla każdego, kto ma polimorfizm w genie MTHFR.
Mutacja w genie MTHFR wpływa niekorzystnie na enzym, który umożliwia folianom przejście do form użytecznych dla organizmu, a tym samym do przebiegu kolejnych skomplikowanych reakcji.
Foliany mają wpływ na metabolizm aminokwasów, czyli związków regulatorowych, transportowych i budulcowych w organizmie.
Gdy jest ich mało lub działają nieprawidłowo może dojść do np. wysokich poziomów homocysteiny, aminokwasu, którego nadmiar jest szkodliwy i wpływa na szereg stanów zapalnych i wolnorodnikowych. Homocysteina to aminokwas uczestniczący w cyklu metylacyjnym (przemiany metioniny).
Polimorfizm MTHFR C677T, często powoduje podniesienie poziomu homocysteiny.
W badaniu krwi, jeśli homocysteina przekroczy 10 mol/l powinniśmy się martwić.
Za wysokim poziomem homocysteiny, kryją się takie schorzenia jak:
- miażdżyca
- zakrzepica
- choroby serca
- choroby z autoagresji
- neurotoksyczne działanie wywiera również wpływ w obrębie mózgu (ch. Parkinsona, Alzheimera)
Jej niskie wartości też nie są wskazane. Homocysteina powinna wahać się między 6,5 mol/l- 8 mol/l. Uczestniczy ona m.in. w produkcji SAM (S- adenozynometionina), oraz glutationu.
Niedobór zatem homocysteiny powoduje niskie poziomy SAM i glutationu, czyli stres oksydacyjny i problemy z metylacją.
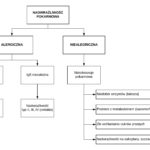
Polimorfizmy MTHFR
Polimorfizm MTHFR A1298C wydawać by się mogło, że nie ma takich skutków klinicznych jak C677T. Jednak homozygota A1298C lub heterozygota A1298C z dodatkiem heterozygoty C677T, może stanowić problem.
Jeżeli MTHFR nie działa prawidłowo, a nasze codzienne wybory w postaci diety i regeneracji pozostawiają wiele do życzenia, możemy spotkać się z:
- problemem ze snem,
- chronicznym zmęczeniem,
- słabą odporność na stres,
- depresjami, nerwicami,
- wahaniami hormonów,
- zespołem jelita drażliwego,
- alergiami,
- miażdżycą,
- chorobami tarczycy i innymi chorobami z autoagresji,
- fibriomialgią,
- „mgłą mózgową”
- migrenami,
- Alzheimerem, Parkinsonem,
- niskim glutationem- zapadalnością na choroby nowotworowe,
- poronieniami,
- problemami z zajściem w ciąże,
- z urodzonymi dziećmi z autyzmem, zespołem Downa lub dziećmi nadaktywnymi psycho-ruchowo i ich problemami zdrowotnymi w postaci alergii, problemów jelitowych, rozwoju…
W przypadku braku problemów z folianami (dobra dieta, właściwa suplementacja), aminokwas – cysteina jest przekształcana do metioniny i homocysteina jest wtedy na optymalnym, bezpiecznym poziomie.
Z metioniny, na drodze przemian, powstaje serotonina, dzięki której m.in. zapadamy w głęboki sen, oraz noradrenalina wpływająca na naszą dzienną aktywność. Oba te związki, to ważne neurotransmitery, optymalizujące system nerwowy i dbające o nasze dobre samopoczucie.
MTHFR i co dalej?
Polimorfizmy to nie choroba, a genetyczne zróżnicowanie populacji. Polimorfizmy mogą wpływać na zdrowie człowieka zwiększając lub zmniejszając ryzyko rozwoju chorób.
Szacuje się, że w ludzkim genomie występuje ponad 10 mln polimorfizmów pojedynczego nukleotydu. Każdy więc ma korzystne i niekorzystne polimorfizmy, które wpływają na zapotrzebowanie na składniki odżywcze, wykorzystanie energii, apetyt, ryzyko występowania chorób przewlekłych, kondycje układu odpornościowego, hormonalnego, nerwowego, a zatem na wszystkie procesy regulacyjne.
Korzystne jak i niekorzystne polimorfizmy są dziedziczone i ich kulminacja ujawnia się zwykle gdy w rodzinie są przypadki problemów z zajściem w ciąże, poronienia, dzieci z problemami rozwojowymi, nowotwory, depresje, samobójstwa…
Z epigenetycznego punku widzenia to wszystko jest do zatrzymania!
Z biochemicznego punktu widzenia to problem w konkretnym miejscu na szlaku biochemicznym. Na ekspresje genów, czyli ujawnienie się jakieś cechy najbardziej wpływa styl życia i dieta!
Co możemy zrobić?
- Zmiana nawyków żywieniowych (zwiększenie ilości różnorodnych zielonych i kolorowych warzyw i owoców, dieta z eliminacją glutenu i produktów mlecznych, zwiększenie w diecie kwasów omega-3, zwiększenie błonnika pokarmowego, wykluczenie z diety produktów przetworzonych m.in. z tłuszczy trans),
- Metylofolian powinien być suplementowany dopiero po zoptymalizowaniu witamin B1, B2, B3, B5, B6 i ważnej witaminy B12 (najlepiej w formie metylokobalaminy lub adenozylokobalaminy, ewentualnie hydroksykobalaminy-wszystko zależy od konkretnego przypadku klinicznego). Cyjanokobalaminie – podziękujmy.
Są przypadki w których osoby nie powinny przyjmować metylofolianu. Dlatego ważny jest kontakt z kimś kto dobrze w tej sytuacji poprowadzi.
Poziom wit B oznaczany we krwi, nie ma przełożenia na aktywną jego formę biorąca udział w reakcjach komórkowych. Dlatego należy sprawdzić morfologię krwi i jeżeli MCV i MCH są podwyższone, możemy mieć do czynienia z niedoborem wit B12 i/lub folianów. - Probiotykoterapia cykliczna i/lub spożywanie fermentowanych produktów spożywczych, ponieważ optymalna flora jelitowa uczestniczy m.in. w wytwarzaniu wit z gr. B. Zdrowe jelita to również zdrowe wchłaniane cennych składników w tym folianów z diety i białek uczestniczących w cyklu metylacyjnym.
- Wsparcie metylacji suplementacją magnezu i cynku- oznaczanie i kontrola ich poziomu.
- Zmiana stylu życia (odpoczynek i kojący kontakt z przyrodą, pasje, dobre relacje międzyludzkie, brak nałogów…)
Rozwój biologii molekularnej i nowych technologii diagnostycznych stworzył nową gałąź nauki i diagnostyki w postaci genomiki żywieniowej, czyli badaniu interakcji genotypu na składniki pożywienia, wpływu pożywienia na ekspresje naszych genów i regulatorów tych ekspresji.
Każdy z nas ma różnice genetyczne. Trzeba zaznaczyć, że są one minimalne, na poziomie 0,1 % sekwencji DNA ale to ma przełożenie na 10 mln polimorfizmów pojedynczego nukleotydu (odmienności podstawowych jednostek budujących genetyczny zapis). Ten niewielki odsetek decyduje o dużej różnorodności stanu zdrowia uwarunkowanego dietą i innymi czynnikami środowiska.
Polimorfizm pojedynczego nukleotydu w nici DNA może mieć różne konsekwencje biologiczne. Jeżeli nasz „wzorzec” sekwencja nukleotydów się zmieni, zmieni się również sekwencja aminokwasów budujących białko. Aktywność takiego białka może wzrosnąć lub osłabnąć. Może dojść do zmiany w konformacji takiego białka czyli zmiany jego budowy, a tym samym zmiany funkcji, może również przez polimorfizm substancji regulacyjnych dojść do powstania niefunkcjonalnego białka, a także zwiększyć lub zmniejszyć ekspresje danego genu.
Składniki odżywcze dla nas to głównie smak i zapach, dla organizmu zaś, reaktywne formy biochemiczne. Formy te w postaci codziennego spożywania pokarmu regulują lub mogą regulować w sposób kontrolowany szlaki sygnałowe, cykl komórkowy, apoptozę, status hormonalny i metabolizm karcynogenów. Inaczej mówiąc włączają lub wyłączają korzystne lub niekorzystne dla nas reakcje.
Nie każdy zachoruje na raka jelita grubego spożywając w dużych ilościach czerwone mięso, nie każdy będzie miał raka płuc paląc papierosy, nie każda szczupła osoba ma prawidłowy lipidogram, nie każdy regeneruje się tak samo po intensywnym wysiłku fizycznym.
Nutrigenetyka staje się indywidualną instrukcją dla każdego z nas. Dzięki niej możemy poznać nasze indywidualne preferencje i określić co nam służy a co szkodzi.
Poznanie wzajemnych zależności między składnikami odżywczymi a genami i ich produktami ma kluczowe znaczenie w spersonalizowanej strategii żywieniowej.
To nowa i obiecująca gałąź diagnostyczna.
Monika Czerepak
dietetyk kliniczny z ofertą on line
www.zdrowe-zmiany.pl
Źródła:
- http://www.ptnd.pl/nd/neurologia_42-11-21.pdf
- http://pdm.org.pl/index.php?option=com_content&view=article&id=80&Itemid=127
- http://www.mthfrsupport.com.au/what-is-mthfr/
- http://www.zespoldowna.info/mutacja-genu-mtrr-66ag-jako-czynnik-ryzyka-urodzenia-dziecka-z-zespolem-downa.html
- http://www.bioautyzm.pl/6-2/
- Stanger i inni (2009). Homocysteine, folate and vitamin B12 in neuropsychiatric diseases: review and treatment recommendations. Expert review of neurotherapeutics 9:1393-1412.
- http://advances.nutrition.org/content/3/1/21.full
- http://www.poradnikzdrowie.pl/zdrowie/domowa-apteczka/kwas-foliowy-wlasciwosci-jaka-jest-rola-kwasu-foliowego_33795.html
- http://www.ptnd.pl/nd/neurologia_42-11-21.pdf
- http://biotechnologia.pl/biotechnologia/krotka-historia-o-metylacji-dlaczego-jest-tak-istotna-dla-zdrowia,16539
- „Nutrigenetyka” Anna Sadakierska- Chudy, (67-118) pod redakcją Elżbiety Poniewierskiej: „Dietetyka oparta na dowodach”, MedPharm Polska, 2016
- „Na początku był głód”, Marek Konarzewski, Państwowy Instytut Wydawniczy, 2015